Bảng Tuần Hoàn Hóa Học: Những Bí Mật Về Các Nguyên Tố
Từ thời học sinh khi bước vào môn Hóa học, chắc chắn không ai là không biết đến Bảng tuần hoàn các nguyên tố hóa học. Nhưng để biết và tìm hiểu về nó một cách chi tiết và đầy đủ nhất lại không phải ai cũng làm được. Cùng tìm hiểu những bí mật thú vị về bảng tuần hoàn hóa học này.
Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Thời Trung cổ, loài người đã biết đến các nguyên tố vàng, bạc, đồng, chỉ, sắt, thủy ngân và lưu huỳnh. Năm 1649, loài người tìm ra nguyên tố photpho. Đến năm 1869, mới có 63 nguyên tố được tìm ra.
Năm 1862, J. Dobereiner nhận thấy khối lượng nguyên tử của Stronti ở giữa khối lượng nguyên tử của hai nguyên tố bari và canxi. Bộ ba nguyên tố đầu tiên này có tính chất tương tự nhau. Tiếp theo, các nhà khoa học đã tìm ra các bộ ba khác có quy luật tương tự.
Năm 1862, nhà địa chất Pháp De Chancourtois đã sắp xếp các nguyên tố hóa học theo chiều tăng của khối lượng nguyên tử lên một băng giấy (băng giấy này được quấn quanh hình trụ theo kiểu lò xo xoắn). Ông nhận thấy tính chất của các nguyên tố giống như tính chất của các con số, và tính chất đó lặp lại sau mỗi 7 nguyên tố.
Năm 1864, John Newlands, nhà hóa học Anh, đã tìm ra quy luật: Mỗi nguyên tố hóa học đều thể hiện tính chất tương tự như nguyên tố thứ 8 khi xếp các nguyên tố theo khối lượng nguyên tử tăng dần.
Năm 1860, nhà bác học người Nga Mendeleev đã đề xuất ý tưởng xây dựng bảng tuần hoàn các nguyên tố hóa học. Năm 1869, ông công bố bản “Bảng tuần hoàn các nguyên tố hóa học” đầu tiên.
Năm 1870, nhà khoa học người Đức Lothar Mayer nghiên cứu độc lập cũng đã đưa ra một bảng tuần hoàn các nguyên tố hóa học tương tự như bảng của Mendeleev.
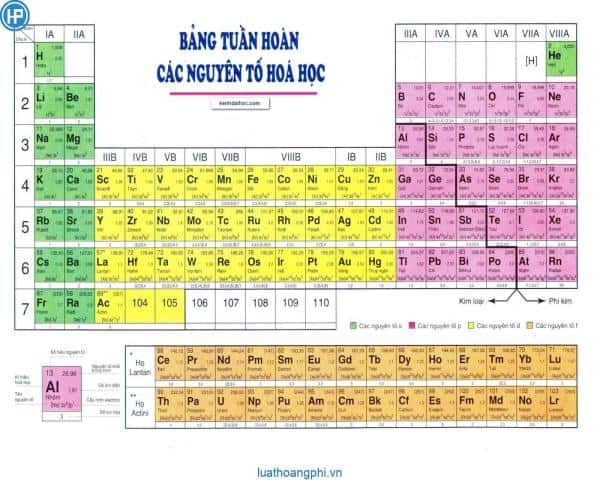
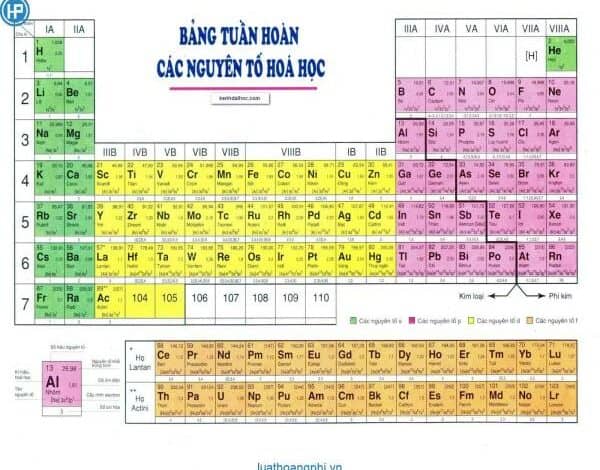
Cấu tạo của bảng tuần hoàn được chia làm ba phần chính
Thứ nhất: Ô nguyên tố
Ô nguyên tố cho biết: số hiệu nguyên tử, ký hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố đó.
Số hiệu của nguyên tử có số trị bằng số đơn vị điện tích hạt nhân và bằng số electron trong nguyên tử. Và số hiệu nguyên tử cũng là số thứ tự của nguyên tố trong bảng tuần hoàn.
Ví dụ: Số hiệu nguyên tử của Magie là 12 cho biết: Magie ở ô số 12, điện tích hạt nhân nguyên tử magie là 12+ (hay số đơn vị điện tích hạt nhân là 12), có 12 electron trong nguyên tử Magie.
Thứ hai: Chu kỳ
Chu kỳ là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được xếp theo chiều điện tích hạt nhân tăng dần.
Số thứ tự của chu kỳ bằng số lớp electron.
Bảng tuần hoàn gồm 7 chu kỳ, trong đó có các chu kỳ 1, 2, 3 được gọi là chu kỳ nhỏ, các chu kỳ 4, 5, 6, 7 được gọi là chu kỳ lớn.
-
Chu kỳ 1: Gồm 2 nguyên tố là H và He, có 1 lớp electron tong nguyên tử. Điện tích hạt nhân tăng từ H là 1+ đến He là 2+.
-
Chu kỳ 2: Gồm 8 nguyên tố từ Li đến Ne, có 2 lớp electron trong nguyên tử. Điện tích hạt nhân tăng từ Li là 3+, … đến Ne là 10+.
-
Chu kỳ 3: Gồm 8 nguyên tố từ Na đến Ar, có 3 lớp electron trong nguyên tử. Điện tích hạt nhân tăng dần từ Na là 11+, … đến Ar là 18+.
-
Chu kỳ 4 và chu kỳ 5: Mỗi chu kỳ đều có 18 nguyên tố, bắt đầu là một kim loại kiềm K là 19+ và Rb là 37+, kết thúc là một khí hiếm Kr là 36+ và Xe là 54+.
-
Chu kỳ 6: Có 32 nguyên tố, bắt đầu từ kim loại kiềm Cs là 55+ và kết thúc là khí hiếm Rn là 86+.
-
Chu kỳ 7: Chưa hoàn thành.
Thứ ba: Nhóm nguyên tố
Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau và do đó có tính chất tương tự nhau được xếp thành cột theo chiều tăng của điện tích hạt nhân nguyên tử.
Số thứ tự của nhóm bằng số electron lớp ngoài cùng của nguyên tử.
Có 2 loại nhóm nguyên tố là nhóm A và nhóm B:
-
Nhóm A: bao gồm các nguyên tố s và p. Số thứ tự nhóm A = tổng số electron lớp ngoài cùng.
-
Nhóm B: bao gồm các nguyên tố d và f có cấu hình electron nguyên tử thì tận cùng ở dạng (n-1)dxnsy:
- Nếu (x+y) = 3 -> 7 thì nguyên tố thuộc nhóm (x+y)B.
- Nếu (x+y) = 8 -> 10 thì nguyên tố thuộc nhóm VIIIB.
- Nếu (x+y) > 10 thì nguyên tố thuộc nhóm (x+y-10)B.
Ví dụ:
-
Nhóm I: Gồm các nguyên tố kim loại hoạt động mạnh. Nguyên tử của chúng đều có 1 electron ở lớp ngoài cùng. Điện tích hạt nhân tăng từ Li (3+), … đến Fr (87+).
-
Nhóm VII: Gồm các nguyên tố phi kim hoạt động mạnh. Nguyên tử của chúng đều có 7 electron ở lớp ngoài cùng. Điện tích hạt nhân tăng từ F (9+), … đến At (85+).
Bảng tuần hoàn hóa học có bao nhiêu nguyên tố?
Tính đến tháng 9 năm 2021, bảng tuần hoàn hóa học có tất cả 118 nguyên tố đã được xác nhận, bao gồm các nguyên tố từ 1 (Hidro) tới 118 (Oganesson).
Cùng với việc công nhận nguyên tố 113 là nguyên tố hóa học, Liên minh Quốc tế về Hóa học cơ bản và ứng dụng (IUPAC) cũng đã chính thức đưa 3 nguyên tố khác với số hiệu nguyên tử lần lượt là 115, 117 và 118 vào bảng tuần hoàn. Điều này được xem như một “bản cập nhật lớn” của bảng tuần hoàn tính từ năm 2011, khi 114 và 116 được đưa vào và giờ đây, chu kỳ 7 đã được lấp đầy, bảng tuần hoàn đã trở nên đầy đặn hơn, giới hạn kiến thức của nhân loại lại được tiến thêm một bậc nhỏ và tài năng “tiên tri” cách đây gần 200 năm của Mendeleev lại một lần nữa được khẳng định.
Sau khi xem xét nghiên cứu hóa học đệ trình bởi các nhà khoa học đến từ Mỹ, Nhật và Nga, IUPAC đã xác nhận 4 nguyên tố mang số hiệu nguyên tử 113, 115, 117 và 118 là đáp ứng các tiêu chí để trở thành nguyên tố mới được phát hiện. Đây đều là những nguyên tố nặng nhất trong bảng tuần hoàn và chưa từng được thấy tồn tại bên ngoài phòng thí nghiệm. Nguyên nhân là do chúng rất kém bền vững, chỉ có thể tạo ra trong phòng thí nghiệm bằng các tổng hợp từ các hạt nhân nhẹ hơn và thật ra, chúng chỉ tồn tại chưa đến một giây trước khi bị vỡ ra thành các nguyên tố khác.
Như vậy có thể thấy, trong tổng cộng 118 nguyên tố hóa học thì có đến 98 nguyên tố xuất hiện trong tự nhiên; 20 nguyên tố còn lại từ Ensteini tới Oganesson, chỉ xuất hiện trong phép tổng hợp nhân tạo. Trong số 98 nguyên tố đó, 84 nguyên tố nguyên thủy, nghĩa là xuất hiện trước khi Trái đất hình thành và 14 nguyên tố còn lại chỉ xuất hiện trong các chuỗi phân rã của các nguyên tố nguyên thủy. Không có nguyên tố nào nặng hơn Einsteini (số hiệu 99) từng quan sát thấy với lượng vĩ mô ở dạng tinh khiết.
Cách xem bảng tuần hoàn hóa học
Để hiểu và sử dụng bảng tuần hoàn hóa học hiệu quả, cần nắm vững các thông tin quan trọng cần thiết như:
-
Số nguyên tử: Số nguyên tử của một nguyên tố hóa học, là số proton trong hạt nhân của một nguyên tử. Số nguyên tử cũng bằng số electron trong một nguyên tử trung hòa về điện.
-
Nguyên tử khối trung bình: Là trung bình của các nguyên tử khối khác nhau của các đồng vị của một nguyên tố.
-
Độ âm điện: Độ âm điện của một nguyên tử là khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học.
-
Cấu hình electron: Cấu hình electron nguyên tử cho biết sự phân bố các electron trong lớp vỏ nguyên tử ở các trạng thái năng lượng khác nhau hay ở các vùng hiện diện của chúng.
-
Số oxi hóa: Là số áp cho một nguyên tử hay nhóm nguyên tử. Nhờ số oxi hóa, chúng ta có thể nhận biết được số electron trao đổi khi một chất bị oxi hóa hoặc bị khử trong một phản ứng.
-
Tên nguyên tố: Là tên gọi của một nguyên tố hóa học, được phân biệt bằng số hiệu nguyên tử.
-
Ký hiệu hóa học: Ký hiệu là tên viết tắt của một nguyên tố hóa học. Các biểu tượng trước đó cho các nguyên tố hóa học bắt nguồn từ từ vựng cổ điển Latin và Hy Lạp.
Cách học thuộc bảng tuần hoàn hóa học
Cách một: Học bảng tuần hoàn thông qua cách học truyền thống
-
Nhận biết các thành phần của mỗi nguyên tố: Bạn đọc phải nhận biết được số nguyên tử, nguyên tử khối trung bình, độ âm điện, cấu hình electron, số oxi hóa, tên nguyên tố, ký hiệu hóa học. Tất cả đều nằm trong ô nguyên tố trên bảng tuần hoàn.
-
Học vài nguyên tố mỗi ngày: Học một lượng nhỏ nguyên tố mỗi ngày giúp não bộ ghi nhớ kiến thức một cách tối đa và lâu dài. Đồng thời, khi học các nguyên tố mới cũng cần ôn lại các nguyên tố cũ để tránh quên.
-
Dán các bảng tuần hoàn hóa học ở khắp nơi: Dán bảng tuần hoàn hóa học ở khắp mọi nơi trong nhà giúp bạn học tập dễ dàng và tiện lợi.
-
Làm thẻ ghi chú cho mỗi nguyên tố: Làm thẻ ghi chú với các thông tin về nguyên tố để mang theo và ôn lại kiến thức bất cứ lúc nào.
-
Phân chia thời gian và cách học hợp lý: Mỗi người có một quỹ thời gian riêng, hãy phân chia thời gian và học ở bất kỳ nơi nào bạn muốn.
Cách hai: Sử dụng công cụ hỗ trợ trí nhớ
-
Sử dụng các câu nói quen thuộc: Sử dụng những câu nói, bài hát, bài thơ để ghi nhớ các nguyên tố hóa học.
-
Chơi các trò chơi trực tuyến để ghi nhớ: Sử dụng các trò chơi trực tuyến để kiểm tra trí nhớ và cải thiện điểm số.
Bảng tuần hoàn hóa học của Mendeleev
Bảng tuần hoàn hóa học là phương pháp dạng bảng hiển thị các nguyên tố hóa học do nhà hóa học Dimitri Mendeleev người Nga phát minh vào năm 1869. Bảng tuần hoàn hóa học có giá trị quan trọng trong việc dự đoán tính chất hóa học của một nguyên tố dựa trên vị trí của nó trong bảng. Bảng tuần hoàn hóa học còn được áp dụng trong nhiều lĩnh vực khác nhau như vật lý, kỹ thuật, công nghiệp và sinh học.
Trên công trình này, chúng tôi đã giới thiệu đến bạn đọc những điều cơ bản và thú vị về bảng tuần hoàn các nguyên tố hóa học. Nếu bạn quan tâm đến việc nghiên cứu và tìm hiểu thêm về các nguyên tố, hóa chất và ứng dụng của chúng, hãy truy cập vào Văn Phòng Tuyển Sinh Y Dược Hà Nội để có thêm thông tin chi tiết và đáng tin cậy.
Hãy cùng khám phá, tìm hiểu và rút ra những bài học bổ ích cho cuộc sống hàng ngày của bạn từ bảng tuần hoàn hóa học. Đó là những bí mật từ các nguyên tố hóa học mà bạn không nên bỏ qua.